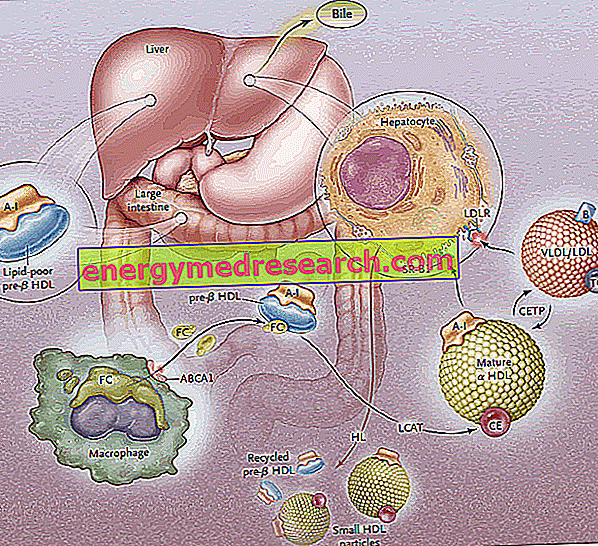
Omgekeerd cholesteroltransport (RCT) is het proces waarbij cholesterol wordt verwijderd uit perifere weefsels, door de opname ervan in HDL-lipoproteïnen en vervolgens transport naar de lever voor uitscheiding via de gal.
Perifere cellen, zoals alle niet-intestinale of hepatische cellen, zijn niet in staat om overtollig cholesterol af te breken; daarom is voor het handhaven van cellulaire homeostase de aanwezigheid van een mechanisme dat is bedoeld om cholesterol uit de cellen te verwijderen essentieel. Dit mechanisme, gericht op het hepatische herstel van overtollig perifeer cholesterol, wordt "reverse cholesteroltransport" genoemd (RCT: reverse cholesteroltransport ).
Laten we het proces in detail bekijken.
De biosynthese van HDL-lipoproteïnen gaat door de synthese en initiële uitscheiding van de belangrijkste eiwitcomponenten (apoproteïnen), gevolgd door de extracellulaire acquisitie van lipiden (fosfolipiden en cholesterol) die leidt tot de verzameling en generatie van rijpe HDL-deeltjes.
De eerste fase van omgekeerd cholesteroltransport bestaat uit de productie, door de darm en de lever, van discoïde voorlopers van HDL, die op hun oppervlak apoproteïnen blootstellen (voornamelijk ApoA-I); Voorlopermoleculen van HDL, pre-B-HDL genaamd, komen aldus vrij, die zeer kleine hoeveelheden cholesterol en lipiden opnemen, in het bijzonder fosfolipiden. De aanwezigheid van deze precursormoleculen op het perifere niveau bevordert de overdracht van overtollige vrije cholesterol (FC) - ontsnappend uit perifere weefselcellen - naar apo AI, door de interventie van een membraantransporter genaamd ATP-bindende cassette A1 (ABCA1) ). Deze transporter bevindt zich op het celoppervlak en in de Golgi-membranen en kan de lipiden van het Golgi-apparaat naar het celmembraan transporteren, waardoor de efflux ervan wordt vergemakkelijkt. Op dit punt, zodra het vrije cholesterol de natieve HDL's binnengaat, komt een plasmatisch enzym van hepatische oorsprong tussenbeide, genaamd plasma lecithine-cholesterol acyltransferase of meer eenvoudig LCAT; dit enzym zet het vrije cholesterol dat is opgenomen in de pre-B-HDL om in cholesterolesters, waardoor de pre-B-HDL wordt omgezet in hun rijpe a-HDL-vorm; in de praktijk zet de continue ophoping van cholesterol in de lipoproteïnekern het schijfachtige HDL om in bolvormige en dikke deeltjes, die verder apoproteïnen uit de lipoproteïne deeltjes rijk aan triglyceriden kunnen verkrijgen en samen smelten. In het hele proces speelt apolipoproteïne AI een sleutelrol, waarbij zowel de activiteit van de ABCA1-transporter als die van de LCAT wordt gestimuleerd. Omdat ApoAI het meest gerepresenteerde apolipoproteïne is in HDL, is de plasmaconcentratie ervan direct gerelateerd aan het HDL-cholesterol.
LET OP: het veresteringsproces is van fundamenteel belang om de herverdeling van cholesterol uit HDL naar het plasmamembraan te voorkomen; dit mechanisme maakt gebruik van het vetzuur op positie twee die aanwezig is in de fosfatidylcholinemoleculen.
Het door LCAT gemedieerde veresteringsproces transformeert vervolgens de pre-B-HDL-moleculen in hun "volwassen" a-HDL-sferische vorm. Deze lipoproteïnen worden vervolgens naar de lever getransporteerd, waar ze cholesterol afgeven, volgens twee verschillende routes.
In een eerste geval levert HDL rijk aan veresterd cholesterol dit lipide op tot lipoproteïnen rijk aan triglyceriden (lipoproteïnen met zeer lage dichtheid en lage dichtheid), vervolgens onderschept door de lever via specifieke receptoren (LDL-R) en uit de bloedsomloop verwijderd. Het doel is om via het LDL-receptorsysteem perifeer cholesterol naar de lever over te brengen, en vervolgens de HDL te "ontladen" van overmatig cholesterol naar het perifere niveau, om ze weer beschikbaar te maken om het te ontvangen van de weefsels; zichzelf te legen van cholesterol, HDL's aanvaarden triglyceriden in ruil en dit gebeurt dankzij het cholesterolesteroverdrachtseiwit (CETP). De taak van dit eiwit is daarom het bevorderen van de herverdeling en het evenwicht van cholesterolesters en triglyceriden tussen de HDL-, LDL-, IDL-, VLDL-, chylomicron- en chylomicron-lipoproteïnen, leidend, als een netto resultaat, tot een verrijking in HDL-triglyceriden, ten koste van cholesterolesters, en een afname van de HDL-grootte.
De tweede route omvat hepatische SR-B1-receptoren voor HDL rijk aan veresterd cholesterol, in de afwezigheid van gelijktijdige afbraak van het eiwitgedeelte van HDL, dat vervolgens wordt gerecirculeerd. In de praktijk kunt u met dit enzym de HDL's uit de inhoud halen en nieuwe pre-B-HDL's regenereren. Een deel van de HDL en de ApoA-I wordt echter geïnternaliseerd en gedegradeerd op het lysosomale niveau, zowel in de lever- als de niercellen. De opname gemedieerd door SR-B1 wordt efficiënter gemaakt door de activiteit van het hepatische lipase, in staat tot hermodellering van de HDL's door de fosfolipiden aan het oppervlak te hydrolyseren en de stroom veresterde cholesterol van de lipoproteïnekern naar het plasmamembraan toe te staan (er wordt verondersteld, tussen de andere, dat ApoE ook betrokken is bij selectieve opname, omdat muizen die deficiënt zijn voor het ApoE-gen een vermindering in de werkzaamheid van deze route vertonen). SR-BI komt voornamelijk tot uiting in de lever, de bijnieren en de eierstok.