Eiwitstructuur
Eiwitten worden gevormd door de vereniging van eenvoudiger moleculen die aminozuren worden genoemd en die door peptidebindingen aan elkaar binden. Twee aminozuurmoleculen vormen een dipeptide, drie een tripeptide enzovoort. We hebben het over polypeptide wanneer deze keten bestaat uit minder dan 100 aminozuren en eiwitten wanneer het aantal afzonderlijke eenheden deze drempel overschrijdt.
In het menselijk lichaam kunnen we ongeveer 50.000 verschillende eiwitmoleculen herkennen, waarvan de functie wordt bepaald door hun aminozuursequentie. Door middel van een reeks reacties kan ons lichaam autonoom de eiwitten synthetiseren die het nodig heeft uit de enkele aminozuren die het voedsel bevat.
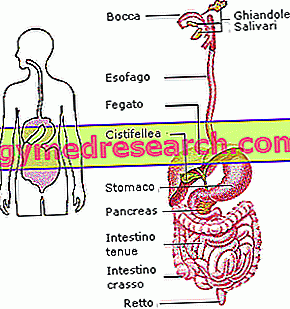
Omdat de eiwitten te groot zijn om als zodanig te worden geabsorbeerd en in de bloedsomloop te worden getransporteerd, komen sommige enzymen die aanwezig zijn in het lumen van het maagdarmkanaal in hun vertering tussen in afzonderlijke aminozuren.
Eiwitdigestie
Tijdens het spijsverteringsproces zijn de meeste eiwitten volledig gereduceerd in individuele aminozuren. De vertering van deze macromoleculen begint in de maag, waar de gecombineerde werking van pepsinogeen en zoutzuur leidt tot de vorming van oligopeptiden (korte ketens van aminozuren gevormd door minder dan tien eenheden).

Eiwitdigestie wordt voltooid door intestinale proteasen van pancreasoorsprong (gegoten in de twaalfvingerige darm) en geproduceerd door het membraan van dezelfde darm (geplaatst op de borstelrand). Om deze reden is de eiwitvertering normaal, zelfs na chirurgische verwijdering van de maag.
Proteasen worden verdeeld in endoproteasen (hydrolyseren de peptidebindingen in eiwitten: chymotrypsine, elastase, trypsine) en exopeptidase (hydrolyseren het terminale aminozuur van het eiwit: carboxypeptidase, aminopeptidase, dipeptidase).
Op intestinaal niveau is de eiwitvertering voltooid en kunnen de individuele aminozuren, dipeptiden en tripeptiden door specifieke dragers worden geabsorbeerd en naar de lever worden getransporteerd. Na het bereiken van deze grote klier, kunnen de individuele aminozuren:
- als zodanig worden gebruikt om bepaalde functies uit te voeren (betrokken bij de immuunrespons, bij de synthese van hormonen en vitamines, bij de overdracht van zenuwimpulsen, bij de productie van energie en als katalysator bij veel metabolische processen)
- deelnemen aan eiwitsynthese, een omgekeerd proces van het spijsverteringsproces dat tot doel heeft het lichaam te voorzien van materialen voor de groei, het onderhoud en de reconstructie van cellulaire structuren
- indien aanwezig in overmaat worden ze gebruikt voor energiedoeleinden (gluconeogenese) of omgezet in vetopslag.
Een kleine hoeveelheid eiwit in voedsel wordt niet geabsorbeerd en wordt als zodanig geëlimineerd met feces (5%). Sommige peptiden gevormd door meer dan drie aminozuren worden geabsorbeerd door transcytose en kunnen als zodanig een significante factor vormen voor de ontwikkeling van voedselallergieën en intoleranties.
Alleen bij de pasgeborene is het mogelijk om hele, onverteerde eiwitten te absorberen. Dit fenomeen is van fundamenteel belang voor de absorptie van antistoffen die via de moedermelk worden overgedragen.

Tweede deel »