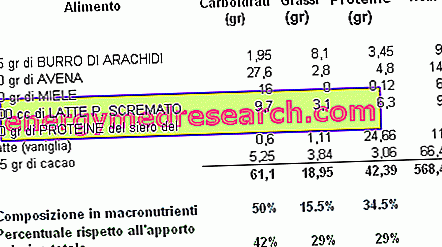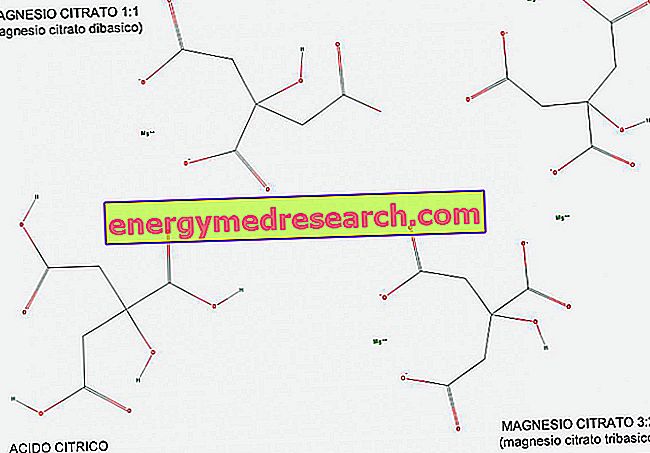
Een tribasisch (of triprotic) zuur is een zuur dat drie waterstofionen heeft om te doneren in een zuur-base reactie. Met behulp van de figuur kunnen we zien hoe citroenzuur een voorbeeld is van tribasisch zuur, omdat het drie COOH-carboxylgroepen heeft die waterstof H gemakkelijk kunnen overbrengen.
Magnesiumcitraat bestaat zowel in een verhouding van 1: 1 (1 magnesiummolecuul per citraatmolecuul), en in een verhouding van 3: 2 (3 magnesiummoleculen per 2 moleculen citraat).
1: 1 magnesiumcitraat wordt dibasisch genoemd omdat het een tweebasisch zout van citroenzuur is; in feite heeft het 2 univalente basisgroepen (COO-) per molecule, afgeleid van de 2 carboxylgroepen die hun waterstof tijdens de reactie hebben opgegeven.
3: 2 magnesium, aan de andere kant, wordt tribasisch genoemd omdat het 3 univalente basisgroepen (COO-) per molecule heeft, afgeleid van de 3 carboxylgroepen die hun waterstof tijdens de reactie opgaven.
Tribasisch magnesiumcitraat is duidelijk rijker aan magnesium (+ 42, 6 gewichtsprocent) dan dibasisch magnesiumcitraat; bovendien is het meer alkaliserend, omdat het drie waterstofionen H + kan accepteren tegen de twee die door de dibasic worden geaccepteerd. Het is echter minder oplosbaar in water.