morfologie
Op macroscopisch niveau kan een variabele graad van corticale atrofie (vermindering van weefsel of orgaanmassa) worden waargenomen bij de ziekte van Alzheimer, gekenmerkt door vergroting van de pariëtale groeven, meer geaccentueerd in de frontale, temporale en pariëtale lobben. Deze atrofie wordt gecompenseerd door een vergroting van de ventriculaire holtes secundair aan het verlies van parenchym (figuur 1). In het bijzonder, in de gevorderde stadia van de ziekte, atrophy de structuren van de mediale temporale kwab, inclusief de hippocampus, de entorhinale cortex en de amygdala, ernstig gezien hun betrokkenheid vanaf de vroege stadia van de pathologie.
Verder presenteert de ziekte van Alzheimer ook microscopische veranderingen, bekend als extracellulaire seniele plaques en intracellulaire neurofibrillaire clusters, die de basis vormen voor histologische diagnose. Met de progressie van de ziekte is er dan een ernstig neuronaal verlies gepaard gliosis (omgeschreven of diffuse proliferatie, reactief van aard, van neurogliacellen, dat wil zeggen cellen die het ondersteunende stroma van zenuwweefsel vormen) in dezelfde regio's waar de aanwezigheid van neurofibrillaire plaques en clusters groter is.
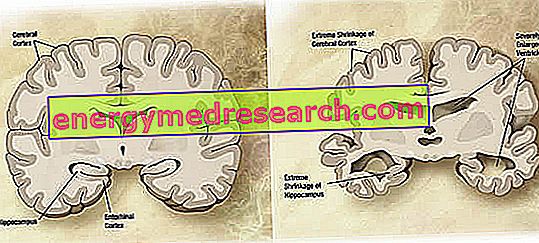
Figuur 1. Coronale sectie van hersenen: verschillen tussen normale hersenen en hersenen beïnvloed door AD (wikipedia-beeldbron).
pathogenese
De ziekte van Alzheimer wordt voornamelijk gekenmerkt door twee typische laesies: de extracellulaire accumulatie van seniele plaques die voornamelijk bestaat uit het β-amyloïde peptide (Aβ) en intraneuronale neurofibrillaire clusters, gevormd door hypergefosforyleerd tau-eiwit.
- Seniele plaques zijn te vinden op het niveau van hersengebieden zoals hippocampus, amygdala en neocortex.
Ap peptide is afgeleid van een proteolytische snede van de amyloïde eiwit precursor (APP), door β-secretase. Deze snede genereert een terminaal carboxyfragment van 99 resten (CTF of C99) dat vervolgens wordt gesneden door het P-secretase om Aß-fragmenten met verschillende lengten te genereren. Het is bekend dat de meest voorkomende soort van Aß het AB40-fragment is. Een ander bekend fragment gevormd uit de proteolytische snede, minder overvloedig dan AP40, is AB42, meer vatbaar voor het vormen van amyloïde fibrillen, die zich als een Ap-species in de hersenen van een individu met de ziekte van Alzheimer accumuleren.
- Een ander bestanddeel dat aanwezig is bij de ziekte van Alzheimer wordt weergegeven door neurofibrillaire clusters bestaande uit bundels van filamenten die aanwezig zijn in het cytoplasma van neuronen. Neurofibrillaire clusters zijn onoplosbaar en lijken in vivo resistent te zijn tegen proteolyseprocessen en blijven dus zelfs lange tijd na neuronale dood aanwezig in weefselsecties. Bij het observeren van de structuur zijn de fibrillaire clusters gemaakt van dubbele helixfilamenten en lineaire filamenten van vergelijkbare samenstelling. Bij analyse van de samenstelling worden de dubbele helixstrengen meestal gemaakt van hypergefosforyleerd tau-eiwit. Tau is een axonaal eiwit dat is geassocieerd met microtubuli, wat de assemblage ervan vergemakkelijkt.
Andere belangrijke neuropathologische veranderingen die aanwezig zijn bij de ziekte van Alzheimer omvatten mitochondriale dysfunctie, oxidatieve neuronale schade, synaptisch verlies en axonale degeneratie.
Neurochemische aspecten
Zoals reeds uitgelegd, vertegenwoordigt Aß-peptide, afgeleid van de proteolytische fractie van de APP-precursor, een neurotoxische component van de ziekte van Alzheimer . Specifiek is de hypothese gesteld dat Aβ belangrijk kan zijn voor normale hersenfuncties en dat het, als het bepaalde concentraties overwint, neurotoxisch kan worden. Bovendien kunnen zowel de aggregaten als de verschillende isovormen van Aβ een andere biologische, fysiologische of pathologische rol hebben, die de volgende stadia van de ziekte bepalen en eraan deelnemen. Er is waargenomen dat Aβ als een neuromodulator fungeert en de afgifte van sommige neurotransmitters beïnvloedt in de afwezigheid van duidelijke tekenen van neurotoxiciteit.
De neuromodulerende rol van Ap, in een fysiologische context, zou bijvoorbeeld een belangrijke betekenis kunnen hebben voor de juiste balans van het neurotransmittersysteem. Het is bekend dat dit systeem bestaat uit neurotransmitters, stoffen die via synaptische transmissie informatie overbrengen tussen de cellen die het zenuwstelsel vormen, de neuronen.
In pathologische omstandigheden kan aan de andere kant Aβ-gemedieerde synaptische transmissie gerelateerd zijn aan verandering van neurotransmissie vóór neurodegeneratieve gebeurtenissen. Als gevolg van deze veranderingen kunnen vroege cognitieve en niet-cognitieve stoornissen ontstaan, gebaseerd op de aangetaste neurotransmittersystemen en de verschillende betrokken hersengebieden.
De veranderingen van de neurotransmittersystemen en het signaaltransductiemechanisme in de hersenen van personen die lijden aan de ziekte van Alzheimer zijn zeer complex. Een van de systemen die lijkt te zijn gewijzigd betreft het cholinerge signaleringssysteem, dat de neurotransmitter acetylcholine omvat. Inderdaad is aangetoond dat personen die lijden aan de ziekte van Alzheimer verminderde cholinerge transmissie vertonen op het niveau van de cortex en de hippocampus, belangrijke hersengebieden gewijd aan verschijnselen zoals leren en geheugen. Naast dit neurotransmittersysteem zijn er veranderingen in de noradrenerge, serotonerge, evenals glutamaat- en GABA-systemen waargenomen bij de ziekte van Alzheimer.



