Kenmerken van het geneesmiddel
Metalyse heeft de vorm van een injectieflacon met een wit poeder en een voorgevulde spuit die een oplosmiddel bevat, om een oplossing voor injectie te vormen.
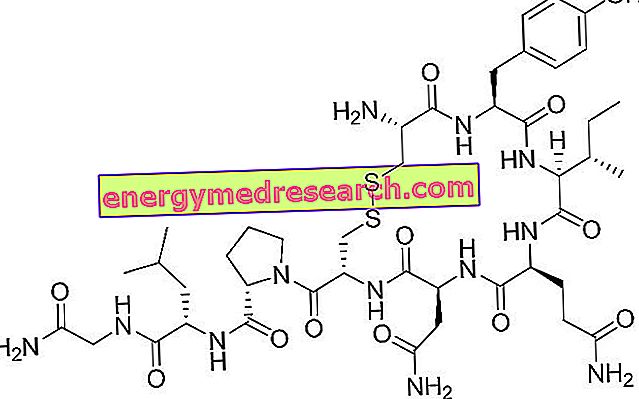
Metalyse bevat de werkzame stof tenecteplase.
Therapeutische indicaties
Metalyse wordt gebruikt om bloedstolsels op te lossen die zijn gevormd in bloedvaten van patiënten met een vermoeden van een acuut myocardiaal infarct (hartaanval).
Metalyse wordt gegeven binnen 6 uur na de eerste symptomen van een hartaanval.
Het geneesmiddel is alleen op doktersvoorschrift verkrijgbaar.
Wijze van gebruik
Metalyse moet worden voorgeschreven door artsen die ervaring hebben met het gebruik van trombolytische behandeling.
Behandeling met Metalyse moet zo snel mogelijk na het begin van een hartaanval worden gestart.
Metlyse dient als een enkele intraveneuze injectie (in een ader) in ongeveer 10 seconden te worden gegeven. De dosis moet geschikt zijn voor het gewicht van de patiënt (zie bijsluiter). Het wordt samen met andere geneesmiddelen (aspirine, heparine) gegeven die de vorming van bloedstolsels voorkomen.
Werkingsmechanismen
Metalyse is een trombolyticum (ook bekend als fibrinolytisch, omdat het bloedstolsels oplost, die zijn gemaakt van een stof die fibrine wordt genoemd). Het werkzame bestanddeel in Metalyse, tenecteplase, is een gemodificeerde vorm van het natuurlijke enzym, activator van humaan plasminogeen. Het wordt geproduceerd door een methode die bekend staat als "recombinant-DNA-technologie": dat wil zeggen, het wordt verkregen uit een cel waarin een gen (DNA) is geïntroduceerd waardoor het in staat is om het te produceren. Tenecteplase is een plasminogeen-activator, dwz het veroorzaakt de transformatie van een stof (plasminogeen) in plasmine. Plasmide breekt stolsels af. Bij hartinfarct hebben stolsels gevormd in de slagaders die naar het hart gaan. Metalyse lost bloedstolsels op en helpt de normale bloedtoevoer naar het hart te herstellen.
Studies uitgevoerd
De werkzaamheid van Metalyse werd geëvalueerd in een groot onderzoek (ASSENT II) bij ongeveer 17.000 patiënten. Metalyse in de vorm van een injectie werd vergeleken met alteplase (een exacte kopie van de plasminogeen-activator van menselijk weefsel geproduceerd met recombinante technologie) als een infusie (indruppeling in een ader). In de onderzoeken werd het sterftecijfer 30 dagen na de behandeling en de mate van bloeding bestudeerd.
Voordelen gevonden na de studies
Metalyse bleek even effectief te zijn als alteplase bij het verminderen van de mortaliteit tot 30 dagen (6, 2% voor beide behandelingen). Metalyse vertoonde een significant lagere incidentie van niet-intracraniale (niet in de hersenen) bloeding in vergelijking met alteplase, wat resulteert in een lagere behoefte aan transfusie.
Gerelateerde risico's
De belangrijkste bijwerking van Metalyse is bloeding, meestal op de injectieplaats. Het kan ook hypotensie, onregelmatige hartslag en pijn op de borst veroorzaken. Deze bijwerkingen komen voor bij meer dan 1 op de 10 patiënten Hersenbloeding (in de hersenen) kan voorkomen bij minder dan 1 op de 100 patiënten, wat kan leiden tot de dood of chronische invaliditeit. Zie de bijsluiter voor de volledige beschrijving van de gerapporteerde bijwerkingen van Metalyse.
Metalyse mag niet worden gebruikt bij mensen die overgevoelig (allergisch) zijn voor tenecteplase of een
een andere excipiënt of voor mensen die bloedingen hebben gehad of recent bloedingen of grote chirurgische operaties hebben ondergaan, of die een ziekte hebben die bloedingen veroorzaakt (bijv. een beroerte in het verleden of ernstige hypertensie). Raadpleeg de bijsluiter voor de volledige lijst met beperkingen.
Redenen voor goedkeuring
Het Comité voor geneesmiddelen voor menselijk gebruik (CHMP) heeft geconcludeerd dat de voordelen van Metalyse groter zijn dan de risico's voor patiënten die trombolytische behandeling van een vermoedelijk hartinfarct nodig hebben. Het CHMP adviseerde daarom om aan Metalyse een vergunning voor het in de handel brengen te verlenen.
Meer informatie
Op 23 februari 2001 heeft de Europese Commissie een in de hele Europese Unie geldige vergunning voor het in de handel brengen afgegeven aan Boehringer Ingelheim International GmbH voor Metalyse.
De handelsvergunning is op 23 februari 2006 verlengd.
Klik hier voor de volledige versie van de evaluatie (EPAR).
Laatste update van deze samenvatting: maart 2006